
最近,长春长生生物科技有限公司问题疫苗事件,在社会上掀起了轩然大波。停产了,抓人了,批捕了,公众对我国疫苗的信任度也骤然下降了。但建国以来我国的疫苗免疫效果和安全性如何?也许统计数据能回答这个问题!
疫苗预防传染病立下汗马功劳
疫苗在传染病的预防和控制中立下了汗马功劳。我国历史上脊髓灰质炎曾广泛流行,20世纪60年代初期,每年报告病例大2万~4.3万例。1960年我国自行研制成功脊髓灰质炎减毒活疫苗,1965年开始在全国逐步推广使用,脊髓灰质炎的发病和死亡人数明显下降;1988年,脊髓灰质炎疫苗接种纳入我国儿童常规免疫计划中,所有儿童均按时接种疫苗。经过几年的努力,我国脊髓灰质炎发病例数大幅下降。1994年,我国报告了最后1例本土脊髓灰质炎病例,提前完成了向世界卫生组织承诺“在中国消灭脊髓灰质炎”的目标。
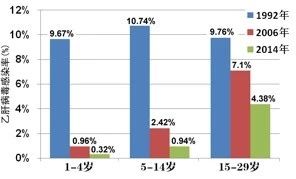
1992年以前,我国属于乙肝高流行地区,人群乙肝病毒表面抗原携带率约9.75%,大约1.2亿人为慢性乙肝病毒感染者,几乎每10人中就有1人是乙肝病毒感染者,每年因乙肝病毒感染相关疾病而死亡的人约有27万人。我国于1992年将乙肝疫苗纳入计划免疫管理,对所有新生儿接种乙肝疫苗。普及接种乙肝疫苗后,我国青年与儿童中的乙肝病毒感染率持续下降,1~4岁、5~14岁、15~29岁人群的感染率从1992年的9.67%、10.74%和9.76%下降到2014年的0.32%、0.94%和4.38%。因此说接种乙肝疫苗是预防乙肝病毒感染最有效的方法。
我国从1962年开始接种白喉疫苗,1978年将百日咳-白喉-破伤风联合疫苗纳入计划免疫,白喉的发病率明显下降。近年来,我国儿童计划免疫中百白破疫苗接种率保持在90%以上。2007~2017年,我国未再发生一例白喉病例。但是,全球仍有许多国家有白喉流行。一旦疫苗接种率下降,白喉很有可能卷土重来。20世纪90年代初期,由于苏联解体,导致疫苗接种率下降,造成俄罗斯等部分前苏联国家白喉流行,至少15万人患病。

图2. 白喉疫苗和百白破疫苗接种后
白喉已在我国消除了10年
我国疫苗的科研能力也逐渐增强。2009年新型H1N1甲流全球大流行,北京科兴仅用3个月的时间就研制出新型H1N1流感疫苗,9个月疫苗获批后立即在全国广泛接种,3个月后就有效地遏制住流感在我国的流行,流感发病人数明显减少。近年来,我国研究的首个戊型肝炎疫苗和手足口病疫苗都得到世界卫生组织的认可。这些事实都说明,我国疫苗的质量是好的。
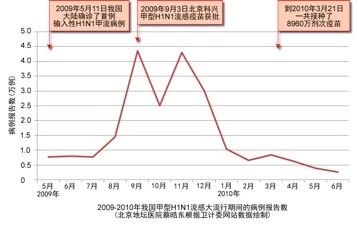
图3. 2009年我国甲流疫苗接种后
流感大流行迅速得到控制
别拿孩子的健康做“赌注”
疫苗可以预防疾病,但有时在接种疫苗后也会出现一些副反应,甚至可能致病。例如,卡介苗、麻疹疫苗、小儿麻痹糖丸等减毒活疫苗里都降低了毒力的活病毒或活细菌,接种到人体内等于导致一次轻症感染。这种轻症感染就属于疫苗的副反应。但如果这些减毒活疫苗毒力减得不够,或者人体的免疫功能缺陷,也可能由疫苗病毒或细菌引起较严重的感染。灭活疫苗引起的副反应与疫苗中的蛋白质、添加剂(佐剂)等有关,这些物质可能导致人体的过敏反应。例如,流感疫苗是把流感病毒接种到毛鸡蛋里繁殖,然后再将其灭活,因此疫苗中有可能含有鸡蛋的蛋白质,对鸡蛋过敏的人就可能对流感疫苗发生过敏反应。但是,在绝大多数情况下,这些副反应或者所致疾病都很轻,很快就会自然痊愈。
接种疫苗后的副反应按发生的原因分为一般反应和异常反应。疫苗一般反应是疫苗本身引起的反应,分为局部反应和全身反应。局部反应一般表现为注射部位红肿、疼痛,多在接种后10小时左右出现,2~3天自行消失。但接种卡介苗的局部反应有时较重,会出现局部化脓,需要2~3周的时间恢复,愈后会留下永久性疤痕。全身反应表现为发热、头痛、倦怠、食欲不振、恶心、呕吐、腹痛、腹泻等,其中发热最为常见,全身症状一般在1~3天后自愈。
疫苗异常反应通常与个人体质有关,主要表现有:无菌性脓肿、过敏反应(如过敏性休克、过敏性皮疹、过敏性紫癜、血小板减少性紫癜、血管性水肿)、神经系统反应(如热性惊厥、癫痫、多发性神经炎、脑炎、脑膜炎),卡介苗引起的淋巴结炎、骨髓炎和全身播散性感染等。
根据我国疑似预防接种异常反应监测数据,我国的疫苗总体安全性较好。
2010~2016年异常反应的报告率:
●百日咳-白喉-破伤风联合疫苗:1.37/10万~1.77/10万
●麻疹-流行性腮腺炎-风疹联合减毒活疫苗:1.36/10万~1.61/10万
●乙型肝炎疫苗:0.40/10万~0.53/10万
●狂犬病疫苗:0.60/10万~0.72/10万
严重反应的报告率:
●百日咳-白喉-破伤风联合疫苗:0.13/10万~0.14/10万
●麻疹-流行性腮腺炎-风疹联合减毒活疫苗:0.19/10万~0.23/10万
●乙型肝炎疫苗:0.17/10万~0.20/10万
●狂犬病疫苗:0.13/10万~0.23/10万
我国疑似预防接种异常反应发生率均未高于世界卫生组织同类疫苗异常反应的发生率。这些数据足以说明,我国疫苗的总体安全性是好的,家长千万不要因担心副反应和质疑疫苗的安全性,拿孩子的健康做“赌注”,拒绝接种疫苗。
疫苗监管严格但透明度不足
由于疫苗接种的对象都是健康人群,因此疫苗的安全性一直备受关注,也是各国家药监部门监测的重点。
为保障疫苗安全和儿童健康,WHO于1968年建立疑似预防接种异常反应(AEFI)监测项目,全球共60个国家参加。美国的疫苗安全监测系统是目前全球范围内发展最成熟的疫苗上市后安全监测系统。在美国FDA的监测网站上,我们可以清楚地看到每年问题疫苗的召回情况:2004~2017年的14年间,该网站上共发布了26次疫苗召回公告,涉及的疫苗包括人乳头瘤病毒4价疫苗、流感嗜血杆菌疫苗、脑膜炎球菌/白喉联合疫苗、乙型肝炎疫苗、H1N1甲流疫苗、肺炎球菌疫苗、狂犬病疫苗、伤寒Vi多糖疫苗、麻风腮联合疫苗。最大的一次召回疫苗事件发生在2007年,美国召回了120万剂效价不稳定的流感嗜血杆菌疫苗。
我国AEFI监测体系自20世纪80年代起步,在各级卫生行政部门所属的疾病预防控制机构和药品监督管理部门所属的药品不良反应监测机构内分别开展,并各自形成一套监测体系。2010年出台的《全国疑似预防接种异常反应监测方案》对AEFI的监测方法和标准进行了统一,初步建立起覆盖全国的AEFI监测系统。但是,由于国家监测数据的透明度不足,导致问题疫苗曝光后公众对疫苗安全的疑虑增加。如不及时纠正,可能成为国家免疫规划实施的阻力。
此次长春长生问题疫苗事件,警示监督执法部门应加强对疫苗质量和安全性的监管,提高疫苗监测的透明度,严厉打击违法行为,不要让疫苗之功被问题疫苗抹杀。
参考来源:
1.中国疾病预防控制中心. 脊髓灰质炎炎知识问答. 2011-8-26.
http://www.chinacdc.cn/jkzt/crb/jshzy/cjwd/201108/t20110826_51208.htm.
2.董德祥. 中国消灭脊髓灰质炎--历史回顾及体会. 国外医学(流行病学传染病学分册). 2004. 31(5): 261-264.
3.杨力实. 2014年最新全国1~29岁人群乙肝血清流调结果发布. 中国医学论坛报. 2015. 2015-8-6 D1版.
4.WHO. Diphtheria. 2014-2-21. http://www.who.int/en/.
5.WHO. 白喉疫苗:WHO立场文件. 2006年1月. http://www.who.int/topics/immunization/positionpapers/zh/.
6.Vitek CR, Wharton M. Diphtheria in the former Soviet Union: reemergence of a pandemic disease. Emerg Infect Dis. 1998. 4(4): 539-550.
7.叶家楷, 李克莉, 许涤沙等. 中国2013年疑似预防接种异常反应信息管理系统数据分析. 中国疫苗和免疫. 2015. (02): 121-131+200.
8.武文娣, 刘大卫, 李克莉等. 中国2012年疑似预防接种异常反应监测数据分析. 中国疫苗和免疫. 2014. (01): 1-12+66.
9.叶家楷, 李克莉, 许涤沙等. 中国2014年疑似预防接种异常反应信息管理系统监测数据分析. 中国疫苗和免疫. 2016. (02): 125-137.
10.武文娣, 李克莉, 郑景山等. 中国2011年疑似预防接种异常反应监测数据分析. 中国疫苗和免疫. 2013. (02): 97-109.
11.武文娣, 刘大卫, 李克莉等. 中国2010年疑似预防接种异常反应监测数据分析. 中国疫苗和免疫. 2012. 18(5): 385-397.
12.叶家楷, 李克莉, 许涤沙等. 中国2015年疑似预防接种异常反应监测分析. 中国疫苗和免疫. 2017. (05): 481-492+511.
13.许涤沙, 李克莉, 武文娣等. 中国2016年疑似预防接种异常反应监测数据分析. 中国疫苗和免疫. 2018. (03): 299-309+322.
14.WHO. Rabies vaccines: WHO position paper. 2010-8-20. http://www.who.int/immunization/documents/positionpapers/en/.
15.WHO. Measles vaccines: WHO position paper. Weekly Epidemiological Record. No.35, 2009, pp. 349-360. http://www.who.int/immunization/documents/positionpapers/en/.
16.WHO. Rubella vaccines: WHO position paper. 2011年7月. http://www.who.int/immunization/documents/positionpapers/en/.
17.WHO. 百日咳疫苗:WHO立场文件. 2010年10月. http://www.who.int/topics/immunization/positionpapers/zh/.
18.WHO. Hepatitis B vaccines: WHO position paper – July 2017. Weekly Epidemiological Record. 2017. 92: 369-392.
19.FDA. Recalls (Biologics). https://www.fda.gov/BiologicsBloodVaccines/SafetyAvailability/Recalls/default.htm.
20.卫生部,国家食品药品监管局. 全国疑似预防接种异常反应监测方案. 2010-06-03. http://www.moh.gov.cn/jkj/s3581/201402/5dd5633d93174a7c8e93d8af7579a613.shtml.
21.赵占杰, 江畅, 梁剑, 刘大卫, 郑慧贞. 中国疑似预防接种异常反应、疫苗接种及疫苗可预防疾病监测系统运行现状和策略分析. 医学动物防制. 2013. (05): 479-485.
22.张英洁. 媒体报道乙型肝炎疫苗导致婴儿死亡事件后中国家长对预防接种的信心下降. 中华预防医学杂志. 2017. 51(6): 518.
版权所有:湖南省药学会 主办单位:湖南省药学会
统一社会信用代码:51430000501422439U
备案号: 湘ICP备19000421号-1,(湘)-经营性2023-0166号
 公安机关备案号:43011102001342
公安机关备案号:43011102001342